Il 'copia-incolla' genetico porta verso la metastasi o la crescita
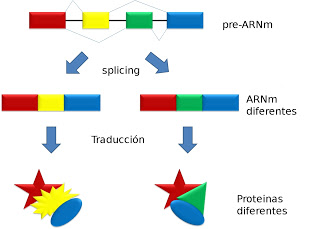
Siamo in piena era genomica. Ormai chiunque può sequenziare il proprio DNA a prezzi abbordabili, con l’auspicio, leggendone la sequenza, di individuare le cause delle malattie e curarle con terapie personalizzate. Ma in realtà solo una piccola frazione del nostro corredo genetico contiene il messaggio che viene tradotto in proteine, il cui numero e proprietà dipendono da come viene ‘letto’ il messaggio conservato dentro i geni. Giuseppe Biamonti e Claudia Ghigna, rispettivamente direttore e ricercatrice dell’Istituto di genetica molecolare del Consiglio nazionale delle ricerche (Igm-Cnr) di Pavia, si occupano da tempo di questo processo, del quale hanno di recente identificato un fattore determinante. Lo studio è pubblicato su Nucleic Acids Research.
“A manipolare il messaggio genico è un complesso meccanismo detto splicing alternativo, una sorta di ‘copia e incolla’ per il quale il messaggio di un gene in certe condizioni dà l’informazione per produrre la proteina A, oppure B, C, D, etc.”, spiega Biamonti. “L’insorgenza e lo sviluppo di una malattia può dipendere da questa modalità di lettura che, a sua volta, è influenzata dall’ambiente in cui si trovano le cellule: un complesso sistema che non ci è ancora chiaro”.
I ricercatori dell’Igm-Cnr hanno dimostrato che lo splicing alternativo dei trascritti di un gene correlato alle condizioni di crescita delle cellule, detto Ron, può influenzare la formazione delle metastasi durante la progressione neoplastica. “Una forma di Ron prodotta da splicing alternativo controlla, la transizione epitelio-mesenchimale (Emt), un processo attraverso cui le cellule dei tessuti epiteliali riescono a muoversi all’interno dell’organismo: necessaria per la formazione dell’embrione e per la rimarginazione delle ferite ma che, se sfortunatamente si verifica nei tumori, conferisce alle cellule cancerose la capacità di invadere i tessuti adiacenti e formare metastasi a distanza”, prosegue Biamonti.
“Dopo aver già provato che la forma ‘metastatica’ di Ron è controllata dai livelli della proteina Srsf1, a loro volta controllati tramite splicing alternativo, il nostro gruppo ora ha identificato un altro fattore, chiamato hnRnp A1, che contrasta Srsf1 e quindi favorisce l’espressione non metastatica di Ron”, spiega Ghigna. “È il rapporto tra i livelli di questi due fattori a decidere se si esprime la forma patologica o non. L’aumento di Srsf1 favorirebbe ovviamente la diffusione delle cellule tumorali, quello di hnRnp A1 ne inibirebbe la crescita e la motilità, attivando la transizione da cellula mesenchimale a cellula epiteliale”.
| Tweet |

