Malattia di Pompe, passi avanti nella sua conoscenza
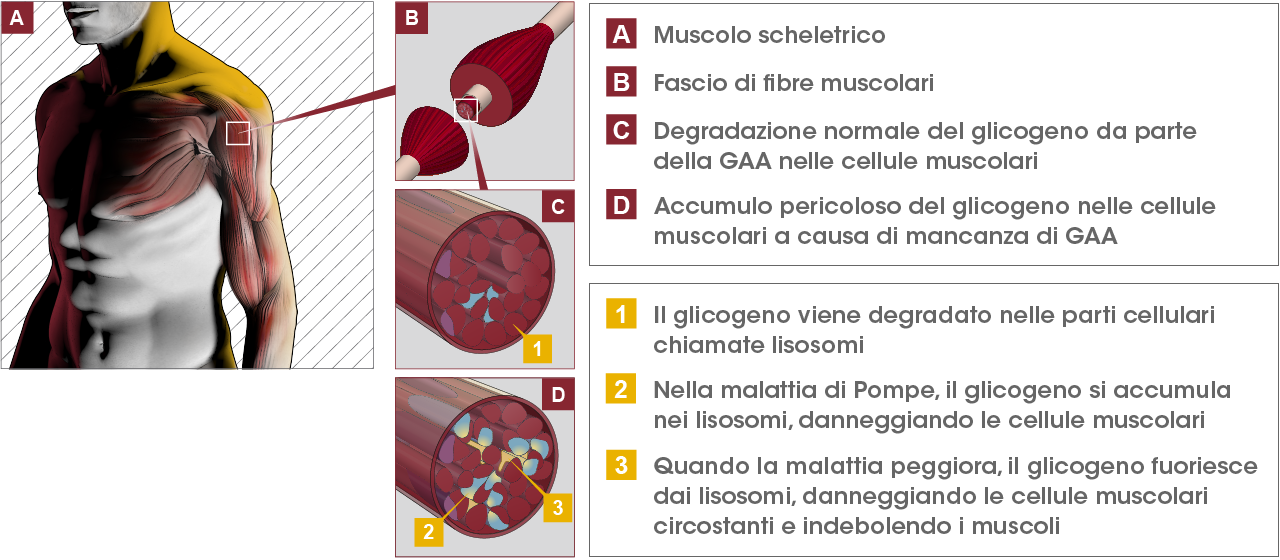
Avanzamenti importanti in arrivo per una delle patologie genetiche rare più comuni, la malattia di Pompe (dal nome del medico olandese che la descrisse per primo), che riguarda circa 10.000 individui nel mondo e circa 300 persone stimate in Italia con effetti devastanti su muscoli scheletrici e cuore difficili da curare. La malattia si manifesta quando l’organismo non produce quantità sufficienti dell’enzima alfa-glucosidasi acida (Gaa) che in condizioni normali permette la degradazione di una sostanza chiamata glicogeno. Ora un team internazionale di scienziati coordinato dal Centre National de la Recherche Scientifique (Cnrs) di Marsiglia, l’Istituto di bioscienze e biorisorse del Consiglio nazionale delle ricerche (Ibbr-Cnr), l’Università di Napoli 'Federico II' ed il Telethon Institute of Genetics and Medicine (Tigem) di Napoli, per la prima volta ha descritto la struttura di questo enzima riuscendo anche a identificare molecole che possono prevenirne l’inattivazione che determina la patologia. I risultati sono pubblicati sulla rivista Nature Communications.
“La funzione normale dell’alfa-glucosidasi acida è di degradare il glicogeno nei lisosomi, delle vere e proprie centrali di smaltimento rifiuti della cellula”, spiega Gerlind Sulzenbacher, la ricercatrice italiana del Cnrs di Marsiglia che ha coordinato lo studio. “Quando una mutazione colpisce il gene dell’alfa-glucosidasi acida, l’enzima non funziona più in modo efficace e il glicogeno si accumula nella cellula con gravi danni tissutali”.
La malattia di Pompe ha esiti diversi a seconda del suo esordio: “La forma infantile è generalmente fatale nel primo anno di vita mentre quella tardiva ha decorsi variabili con progressivo indebolimento dei muscoli e complicazioni respiratorie e cardiache”, spiega Giancarlo Parenti docente presso il Dipartimento di scienze mediche traslazionali dell’Università di Napoli 'Federico II' e ricercatore del Tigem di Napoli. “La terapia enzimatica sostitutiva (Ert) che viene utilizzata attualmente per il trattamento della malattia consiste nel somministrare ai pazienti dosi massicce di enzima così da attenuare l’accumulo di glicogeno. Nonostante i benefici clinici della Ert, la risposta dei pazienti è variabile e la terapia non del tutto efficace. Per questo, da alcuni anni, stiamo studiando un approccio alternativo, la terapia con 'chaperoni' farmacologici o Pct. Si tratta di piccole molecole in grado di legarsi sia all’enzima mutante, sia a quello normale che viene usato per la terapia sostitutiva, aiutandolo a raggiungere il lisosoma per espletare la propria funzione di smaltimento del glicogeno”.
Grazie a esperimenti di cristallizzazione e di diffrazione ai raggi X i ricercatori sono riusciti ad analizzare nel dettaglio la struttura dell’enzima. “Abbiamo determinato la struttura tridimensionale dell’alfa-glucosidasi acida in forma libera e legata a diversi chaperoni che potranno prevenire l’inattivazione dell’enzima e agire da farmaci”, conclude Marco Moracci ricercatore associato dell’Ibbr-Cnr e docente presso il Dipartimento di biologia dell’Università di Napoli 'Federico II'. “In particolare abbiamo scoperto che una di queste molecole, la 'N-acetil-cisteina' (Nac), essendo un farmaco già impiegato come mucolitico, potrebbe anche essere già disponibile per l’impiego clinico. I farmacologi molecolari potranno valutare se anche altre molecole, magari già approvate come farmaci quali il Nac e dunque di impiego immediato in terapia, sono in grado di stabilizzare l’enzima offrendo nuove terapie per combattere questa malattia”.
| Tweet |

